Degenerative Erkrankungen von Gehirn und Rückenmark
Amyotrophe Lateralsklerose (ALS)
Amyotrophe Lateralsklerose (ALS, Charcot-Krankheit): Ursächlich unklare, unheilbare Erkrankung mit fortschreitenden Lähmungen durch Untergang der Nervenzellen, welche die Skelettmuskulatur steuern. Die Erkrankung zeigt zwar einen unterschiedlichen Verlauf, führt jedoch letztlich immer zum Tode.
Leitbeschwerden
- Schmerzlose asymmetrische Muskelschwäche, oft beginnend an den Händen oder Füßen (etwa fehlende Kraft der Hände bei der Hausarbeit, Aus-der-Hand-Fallen von Gegenständen, Hängenbleiben der Füße an Treppenstufen)
- Eventuell „verwaschene“ Sprache, Schluck- und Atemstörungen
- Im weiteren Verlauf Muskelschwund, spastische Lähmungen, häufige Muskelkrämpfe.
Erkrankung und Therapie
Die Nervenzellen, von denen die Impulse für die Skelettmuskulatur und damit für die willkürlichen Bewegungen ausgehen, befinden sich in der Großhirnrinde. Die Signale gelangen ins Rückenmark und werden dort auf eine zweite Nervenzelle umgeschaltet. Bei der amyotrophen Lateralsklerose gehen diese Nervenzellen in Gehirn und Rückenmark aus bisher ungeklärter Ursache zugrunde.
Die amyotrophe Lateralsklerose beginnt meist nach dem 40. Lebensjahr, oft mit Muskelschwäche der Hände oder Füße, seltener mit Schluck- oder Sprachstörungen. Die Lähmungen breiten sich auf den ganzen Körper mit Ausnahme der Augen aus. Typisch sind unwillkürliche Muskelzuckungen sowie eine Kombination aus Muskelschwund (z. B. „Einfallen der Hände“) und erhöhter Muskelgrundspannung (Spastik) vor allem der Beine.
Das macht der Arzt
Wichtigste diagnostische Maßnahmen sind die Messung der Nervenleitgeschwindigkeit und die Elektromyografie, d. h. die elektrische Untersuchung von Skelettmuskeln. Die Creatin-Kinase, ein Enzym (Eiweiß) im Blut, das auf einen Muskelzellzerfall hindeutet, ist leicht erhöht. Um die folgenschwere Diagnose nicht vorschnell zu stellen und andere, möglicherweise behandelbare Krankheiten nicht zu übersehen, werden der Liquor untersucht und ein Kernspin von Gehirn und Rückenmark angefertigt.
Zur Verzögerung des Krankheitsverlaufs steht bisher nur das Medikament Riluzol (Rilutek®) zur Verfügung, das aber den weiteren Nervenzelluntergang letztlich nicht verhindern kann. Medikamente, Krankengymnastik, Ergotherapie und Logopädie sowie später eine geeignete Hilfsmittelversorgung sollen dem Kranken möglichst lange Selbstständigkeit und Kommunikation ermöglichen. Bei Schluckstörungen wird der Patient frühzeitig über eine Sonde ernährt, damit er sich nicht verschluckt und dadurch eine Lungenentzündung bekommt. Umstritten ist hingegen eine Beatmung bei Versagen der Atemmuskulatur.
Ganz wichtig ist eine psychosoziale Betreuung des Kranken, der seine fortschreitende Hilfsbedürftigkeit bei vollem Bewusstsein erlebt. Diese soll dem Patienten trotz zunehmender Pflegebedürftigkeit ein möglichst selbstbestimmtes Leben ermöglichen und z. B. zu der Entscheidung befähigen, wie weit er Maßnahmen zur Lebensverlängerung (wie etwa die oben genannte Beatmung) wünscht.
Huntington-Krankheit
Huntington-Krankheit (Chorea Huntington, früher erblicher Veitstanz): Genetisch bedingte Nervenerkrankung, die mit fortschreitenden Bewegungsstörungen wie Grimassieren und anderen überschießenden Bewegungen sowie geistigem Verfall einhergeht und nach 15–20 Jahren zum Tode führt. Je nachdem, welche Bewegungsstörungen dominieren, wird zwischen der choreatischen und der selteneren akinetisch-rigiden Form unterschieden.
Gegen die Ursache der Chorea Huntington gibt es keine Medikamente. Die Therapie der Erkrankung erschöpft sich in symptomatischer Behandlung einzelner Beschwerden wie z. B. der begleitenden Depression und dem Versuch, die Überbewegungen auszubremsen. Begleitend können Physiotherapie, Ergotherapie und eventuell eine Psychotherapie das Leiden der Patienten lindern.
Symptome und Leitbeschwerden
- Persönlichkeitsveränderungen, z. B. Reizbarkeit, Enthemmung, Pflichtvernachlässigung, Depression, Antriebslosigkeit
- Einsetzen der Krankheitszeichen meist zwischen dem 30. und 50. Lebensjahr
- Sprech- und Schluckschwierigkeiten
- Choreatische Form: Plötzliche unwillkürliche Bewegungen, plötzlich einschießende "Überbewegungen" (Hyperkinesien), Gangstörungen und erhöhte Fallneigung
- Geistiger Abbau bis zur Demenz
- Gewichtverlust aufgrund eines erhöhten Grundumsatzes
- Schluckstörungen.
Wann zum Arzt
In den nächsten Tagen, wenn
- oben genannte Bewegungsstörungen auftreten.
Die Erkrankung
Ursachen und Risikofaktoren
Die Ursache der Huntington-Krankheit ist ein Gendefekt auf Chromosom 4. Dieser Defekt im sogenannten Huntington-Gen führt dazu, dass das Huntington-Protein falsch produziert wird. Das fehlerhafte Protein hat toxische Effekte, es löst den Untergang von Nervenzellen aus und damit auch die klinischen Beschwerden wie Bewegungsstörungen, Persönlichkeitsveränderungen und geistigen Abbau.
Der Defekt im Huntington-Gen kann zwar prinzipiell wie jeder andere Gendefekt neu entstehen, in 97 % der Fälle ist er jedoch autosomal-dominant vererbt. Danach haben Kinder eines Betroffenen ein 50%iges Erkrankungsrisiko, und zwar unabhängig vom Geschlecht. Dagegen besteht (praktisch) kein Risiko, wenn die Eltern gesund sind.
Verlauf
Etwa ab dem mittleren Erwachsenenalter kommt es zu Abbauprozessen im Gehirn, die zwar bestimmte Gehirnanteile bevorzugt befallen, letztlich aber das gesamte Gehirn betreffen. Erstes Symptom ist meist eine Wesensveränderung wie eine erhöhte Reizbarkeit oder depressive Verstimmungen. Im weiteren Verlauf bildet sich dann das Vollbild der Erkrankung mit den typischen, choreatischen Bewegungen aus. Dazu gehören zunächst vor allem die plötzlich einschießenden "Überbewegungen" (Hyperkinesien) im Gesicht und an den Armen, wie Grimassieren und Klavierspielerbewegungen. Später kommen häufig Wortkargheit, Schluckstörungen mit Gewichtsabnahme und eine Demenz dazu. Die Krankheit schreitet unaufhaltsam fort und endet nach 15–20 Jahren tödlich.
Diagnosesicherung
Die typischen Bewegungsstörungen lenken den Verdacht auf eine Chorea Huntington. Der Arzt nimmt eine gründliche neurologische Untersuchung vor und ermittelt den Beschwerdegrad der Störungen mithilfe einer Diagnose-Skala (Unified Huntington´s Disease Rating Scale). Ebenfalls untersucht und dokumentiert werden psychiatrische Beeinträchtigungen wie Persönlichkeitsveränderungen, Depressionen und Zwänge sowie die psychoneurologischen Beschwerden wie Gedächtnisstörungen und Abnahme des Sprachflusses.
Seit 1993 kann der ursächliche Gendefekt in einer Blutprobe nachgewiesen werden. Es handelt sich um krankhafte Veränderungen eines bestimmten Abschnitts der DNS. Je öfter dieser Genabschnitt wiederholt vorhanden ist, desto früher (Lebensalter) und desto schwerer bricht die Krankheit aus. Um diesen Gentest durchzuführen sind ein Aufklärungsgespräch und die schriftliche Einwilligung des Patienten erforderlich.
Lehnt der Patient einen Gentest ab, versuchen die Ärzte mit verschiedenen apparativen Untersuchungen wie dem CT, dem Kernspin oder der Positronenemissions-Tomografie (FDG-PET) die Diagnose zu unterstützen oder andere Ursachen (siehe Differenzialdiagnosen) für die Bewegungsstörungen auszuschließen.
Differenzialdiagnosen. Bewegungsstörungen nach Art der Chorea Huntington treten auch bei anderen Erkrankungen auf, z. B. nach einem Schlaganfall, bei Hyperthyreose oder Morbus Wilson und als sogenannte Spätdyskinesien als medikamentöse Nebenwirkung bei der Therapie mit Neuroleptika.
Behandlung
Eine Therapie gibt es bis heute nicht, die Beschwerden können nur durch Medikamente, Physiotherapie und Logopädie gelindert werden. Viele Erkrankte sind depressiv, die Selbsttötungsrate ist erhöht, eine engmaschige psychologische Betreuung daher unverzichtbar.
Zur symptomatischen Behandlung stehen folgende Wirkstoffe und Verfahren zur Verfügung:
- Gegen überschießende Bewegungen (Hyperkinesien) verordnen die Ärzte meist Tiaprid und Tetrabenazin. Tetrabenazin soll effektiver sein als Tiaprid, hat aber ein ungünstigeres Nebenwirkungsprofil (es soll Depressionen, Benommenheit und Schlafstörungen verursachen und die Suizidalität erhöhen). Deshalb leiten die Ärzte die Therapie meist mit Tiaprid ein, bei Verschlechterung verordnen sie Tetrabenazin (evtl auch in Kombination mit Tiaprid). Zahlreiche weitere Wirkstoffe sind in der Erprobung, mit z. T. widersprüchlichen Ergebnissen. Bleiben Medikamente wirkungslos, kann unter Umständen die tiefe Hirnstimulation helfen. Auch sie wird in Studien getestet, eine abschließende Beurteilung steht noch aus.
- Bei Depressionen verordnen die Ärzte vor allem Antidepressiva vom Typ SSRI, bei gleichzeitigen Schlafstörungen auch Mirtazapin.
- Gegen Zwangssymptome können Antidepressiva vom Typ SSRI, Antipsychotika oder Clomipramin helfen, evtl. auch psychotherapeutische und verhaltenstherapeutische Maßnahmen.
- Psychosen und Wahnvorstellungen erfordern häufig den Einsatz von Antipsychotika wie Olanzapin, Clozapin oder Haloperidol.
- Leichte Schlafstörungen behandelt man mit Mirtazapin oder Hydroxycin. Im Spätstadium, wenn ein mögliches Abhängigkeitsrisiko vernachlässigt werden kann, auch mit Benzodiazepinen sowie Zolpidem oder Zopiclon.
Gentest bei Verwandten von Erkrankten
Mithilfe des prädiktiven Gentests können Verwandte von Erkrankten herausfinden, ob sie ebenfalls von dem Gendefekt betroffen sind. Doch es stellt sich die Frage, welche Bürde größer ist – die der Ungewissheit, die immer noch Hoffnung lässt, oder die des Wissens darum, dass es bis heute keine wirkungsvolle Behandlungsmöglichkeit gibt? Nicht wenige (eventuell) Betroffene lehnen aus diesem Grund jegliche Diagnostik ab.
Alle anderen lassen sich am besten in einem Huntington-Zentrum beraten, wobei die strengen ethischen Richtlinien für die Anwendung des Gentests (z. B. absolute Freiwilligkeit, Mindestalter 18 Jahre) nur ein Bestandteil der Beratung sind. Die Entscheidung abnehmen kann allerdings auch die beste Beratung nicht.
Prognose
Die Krankheit ist nicht heilbar, sie führt nach etwa 15–20 Jahren zum Tode. Häufige Todesursachen sind Pneumonie und Suizid.
Ihr Apotheker empfiehlt
Die voranschreitende Erkrankung ist für die Patienten selbst und für ihre Angehörigen eine große Belastung. Es gilt, Strategien für den Alltag zu entwickeln und alle möglichen Hilfsangebote wahrzunehmen. Dabei unterstützen sowohl Huntington-Selbsthilfegruppen (Deutsche Huntington-Hilfe (www.dhh-ev.de), Schweizerische Huntington Vereinigung (www.shv.ch), Österreichische Huntington-Hilfe (www.huntington.at), aber auch die Krankenkassen. Einige wichtige Maßnahmen sind:
- Kümmern Sie sich als Angehöriger frühzeitig um Behandlungen wie Logopädie, Ergotherapie und Krankengymnastik.
- Lassen Sie sich beraten, welche Pflegeunterstützung und welche Hilfsmittel Ihnen zustehen! Es gibt spezielle Rollstühle und Betten für Chorea-Patienten, außerdem brauchen viele Patienten auch einen Sturzhelm.
- Sorgen Sie dafür, dass der Huntington-Patient eine Patienten- und Betreuungsverfügung frühzeitig, d. h. noch im Besitz seiner vollen geistigen Kräfte, aufsetzt. Nur so sind seine diesbezüglichen Wünsche rechtskräftig und können (und müssen) von allen berücksichtigt werden.
Tipps zur Ernährung von Huntington-Patienten
Für Huntington-Patienten ist das Essen nicht nur ein Genuss, sondern auch mehr als notwendig. Bei einer Gewichtsabnahme droht die Verschlechterung der Krankheit.
- Ausreichend Kalorien. Achten Sie auf eine gute und ausreichende Ernährung! Huntington-Patienten haben einen erhöhten Grundumsatz (bis zu 6000 kcal/Tag).
- 6–8 Mahlzeiten. Günstig sind 3 Hauptmahlzeiten am Tag, dazu kommen Zwischenspeisen, eventuell auch mit hochkalorischer Flüssignahrung.
- Süßes ist erlaubt. Neben der gesunden Vollwertkost braucht der Huntington-Patient auch Zucker, da Zuckermangel beim Untergang der Hirnzellen eine Rolle spielt.
- Weiche Kost. Huntington-Patienten ermüden oft schnell beim Kauen. Hier hilft weiche Kost, wie weiche Kartoffeln, gegartes Gemüse, weiches Obst.
- Verschlucken vermeiden. Auch bei Schluckstörungen hilft weiche Kost. Achten Sie aber darauf, dass diese nicht zu flüssig ist: Schreiben Sie mit dem Stiel eines Holzlöffels eine 8 auf die Oberfläche des Nahrungsmittels. Ist sie deutlich sichtbar bevor sie verschwindet, stimmt die Konsistenz. Bei zu flüssiger Nahrung drohen das Verschlucken und die Gefahr, dass die Nahrung in der Lunge landet und eine Lungenentzündung auslöst.
- Vorsicht mit Alkohol! Alkohol kann die Beschwerden verschlimmern und sollte deshalb vermieden werden.
- Schnabeltasse & Co. Nutzen Sie frühzeitig Esshilfen wie Schiebelöffel und Schnabeltassen. Ist die Nahrungsaufnahme nicht mehr möglich, braucht der Patient eine Magensonde, z. B. eine PEG.
Weiterführende Informationen
https://www.huntington-hilfe.de Deutsche Huntington-Hilfe e. V., Duisburg: Informative Internetseite einer Selbsthilfeorganisation von Betroffenen, Ärzten und Pflegekräften.
https://www.dgn.org/leitlinien/3498-2017-chorea-morbus-huntington
Parkinson-Krankheit
Parkinson-Krankheit (Schüttellähmung, Morbus Parkinson, Paralysis agitans, idiopathisches Parkinson-Syndrom, primäres Parkinson-Syndrom): Degenerative, fortschreitende Erkrankung des Nervensystems, die mit typischen Folgen wie Zittern in Ruhe ("Schütteln"), Muskelsteife und Bewegungsverlangsamung bzw. -armut einhergeht. Ursache ist ein zentraler Dopaminmangel durch vorzeitigen Untergang von Dopamin-produzierenden Nervenzellen im Gehirn.
In Deutschland leben rund 250.000 Erkrankte, vornehmlich Ältere: 1–2 % der über 60-Jährigen und 3 % der über 80-Jährigen sind betroffen. Trotz guter Behandlungsmöglichkeiten in den Frühstadien schreitet die Erkrankung häufig bis zur Invalidität fort. Eine optimale Behandlung kann aber den Krankheitsverlauf und damit Folgeerscheinungen oft verzögern sowie – vor allem bei Krankheitsbeginn im Alter – dazu beitragen, dass die Lebenserwartung fast normal ist.
Symptome und Leitbeschwerden
Zu Beginn oft schwer einzuordnende und meist leichte Beschwerden:
- Steifigkeitsgefühl der Muskeln
- Geruchsstörungen (häufig bereits Jahre vor Ausprägung der anderen Beschwerden)
- Handzittern, das bei gezielter Bewegung aufhört
- Vornübergebeugte Haltung
- Schlurfen, kleinschrittiger Gang
- Veränderungen der Sprache, insbesondere eine leise oder monotone Sprache
- Veränderungen der Handschrift, vor allem ein Kleinerwerden der Buchstaben bei längerem Schreiben
- Depressive Verstimmung und Vitalitätsverlust, Schlafstörungen
- Oft vermehrter Speichelfluss und tränende Augen
- Möglicherweise Stürze ohne erkennbare Ursache.
Bei fortgeschrittener Erkrankung besteht eine typische Kombination aus:
- Langsamem Ruhezittern (also ohne, dass eine Bewegung beabsichtigt ist), an den Händen besonders charakteristisch und als Pillendreher-Tremor bezeichnet
- Erhöhung der Muskelgrundspannung ("steife" Muskeln)
- Bewegungsarmut (z. B. kaum Mimik, wenig automatisches Mitbewegen der Arme beim Gehen).
Als Hauptsymptome der Parkinson-Krankheit gelten: Akinese (Bewegungsarmut mit langsamen, schwerfälligen Bewegungen und wenig automatischen Mitbewegungen), Tremor (unbeeinflussbares Zittern, vor allem in Ruhe) und Rigor (Steifigkeit).
Wann zum Arzt
In den nächsten 1–2 Wochen, wenn
- oben genannte Beschwerden wie z. B. Handzittern in Ruhe oder Bewegungsstörungen auftreten.
Sofort den Arzt rufen, wenn
- ein Parkinson-Kranker verwirrt wirkt, Wahnvorstellungen oder Halluzinationen hat, die Muskeln so "steif" werden, dass sich der Kranke gar nicht mehr bewegen oder seine Tabletten nicht mehr schlucken kann.
Die Erkrankung
Krankheitsentstehung
Für das Zustandekommen flüssiger Bewegungen reicht es nicht aus, dass das Großhirn Befehle an die Muskeln sendet, sich zusammenzuziehen. An einem normalen Bewegungsmuster sind viele Strukturen im Gehirn beteiligt, unter anderem auch die mitten im Großhirn gelegenen Basalganglien. Diese Basalganglien wiederum sind von Zellen im Mittelhirn abhängig, die den Botenstoff Dopamin bilden. Da sie dunkel gefärbt sind, werden sie in ihrer Gesamtheit auch als schwarze Substanz (Substantia nigra) bezeichnet.
Bei der Parkinson-Krankheit gehen die Dopamin-bildenden Zellen in der Substantia nigra zugrunde, der Auslöser dafür ist bisher noch nicht bekannt. Der nachfolgende Dopaminmangel bringt das Botenstoffgleichgewicht durcheinander und stört die normale Funktion der Basalganglien, wodurch die typischen Symptome und Bewegungsstörungen des Morbus Parkinson entstehen.
Verlauf
Anfangs sind die Beschwerden uncharakteristisch und werden deshalb oft fehlgedeutet. So äußert sich die typische Muskelsteife, hier Rigor genannt, nicht selten zunächst in hartnäckigen "Muskelverspannungen", die als Bandscheibenbeschwerden interpretiert werden. Oder das oft zunächst leichte einseitige Zittern (Tremor) der Hände wird auf das "Alter an sich" oder vielleicht auf Nervosität zurückgeführt. Auch die allgemeine Bewegungsarmut (Akinese) beginnt schleichend als verlangsamte Bewegungen (Bradykinese) und fällt daher lange nicht auf. Ein Mangel an Mimik und Gestik wird mitunter als Teilnahmslosigkeit und Schwinden der geistigen Kräfte interpretiert. Das ist jedoch falsch, denn die geistigen Fähigkeiten der Kranken sind in diesem Stadium meist voll erhalten. Recht häufig sind allerdings Depressionen (die dann diagnostisch weiter in die Irre führen).
Bei stärkerer Ausprägung entwickelt sich die charakteristische Körperhaltung beim Gehen mit kleinschrittigem, vornüber geneigtem Gangbild. Hinzu kommen Start- und Stoppschwierigkeiten von zielgerichteten Bewegungen und eine erhöhte Sturzgefahr. Die bei der fortgeschrittenen Parkinson-Krankheit häufigen vegetativen Beschwerden in Form von vermehrtem Schwitzen, Blutdruckabfall im Stehen, Verstopfung durch verlangsamte Darmtätigkeit sowie Blasenfunktionsstörungen gehen vermutlich darauf zurück, dass mit der Zeit andere Nervenzellen (wenn auch in geringerem Maß) absterben.
Mit zunehmendem Alter und Krankheitsdauer kommt es bei der Parkinson-Krankheit bei einem Teil der Erkrankten zu einer Demenz.
Verschiedene Formen, verschiedene Krankheitsursachen
Auf welche Ursache der Untergang der Dopamin-bildenden Zellen bei der Parkinson-Krankheit zurückgeht, ist nicht geklärt (deshalb auch primäres oder idiopathisches Parkinson-Syndrom). Vermutlich besteht eine erbliche Veranlagung, möglicherweise spielen Umweltgifte eine Rolle.
Abzugrenzen davon ist das (symptomatische) Parkinson-Syndrom (sekundäre Parkinson-Syndrom) mit gleichen Beschwerden, jedoch feststellbaren Ursachen. Es wird ausgelöst durch
- Medikamente mit sogenannten "antidopaminergen" Medikamentennebenwirkungen. Ein solches medikamenteninduziertes Parkinson-Syndrom entsteht vor allem bei der Therapie mit
- Neuroleptika
- Metoclopramid, einem Wirkstoff, der häufig gegen Erbrechen eingenommen wird (z. B. Paspertin®)
- Lithium zur Behandlung manischer Episoden bei der bipolaren Depression
- Valproat zur Behandlung einer Epilepsie
- Flunarizin zur Vorbeugung von Migräneattacken.
- Durchblutungsstörungen, Gehirnentzündungen (z. B. durch HIV) und Verletzungen im Bereich des Gehirns
- Vergiftungen, z. B. mit Kohlenmonoxid oder Manganstaub (z. B. bei langjährigen Tätigkeiten im Erzbergbau oder als Elektroschweißer)
- Angeborene Stoffwechselerkrankungen wie z. B. die Störung des Kupferstoffwechsels (Morbus Wilson).
Notfall: akinetische Krise
Kann sich der Kranke plötzlich nicht mehr bewegen, nicht sprechen und nicht schlucken, liegt eine akinetische Krise vor, die umgehend intensivmedizinisch behandelt werden muss, häufig müssen die Ärzte sogar intubieren, um die Beatmung sicherzustellen. Gegen die Bewegungsstörungen bekommt der Patient Amantadin, Apomorphin und L-Dopa (mehr zu diesen Medikamenten siehe unten). Auslöser sind meist andere Erkrankungen, z. B. eine fieberhafte Infektion oder eine Unterbrechung der Medikamenteneinnahme.
Diagnosesicherung
Die Parkinson-Krankheit ist vor allem eine klinische Diagnose. Zunächst lässt sich der Arzt genau berichten, welche Beschwerden der Patient hat und wie lange diese schon dauern. Er forscht nach vorangegangenen Erkrankungen wie Gehirnentzündungen oder Schlaganfall und überprüft die Medikamente, die der Patient einnimmt.
In der ausführlichen neurologischen Untersuchung prüft der Arzt die drei Hauptkriterien (Akinese, Tremor, Rigor) mithilfe verschiedener Tests. Auch das Gangbild und die Körperhaltung werden genauestens beurteilt. In manchen Fällen kommt der sogenannte Sniffin-Test zum Einsatz: Dabei soll der Patient den Geruch standardisierter Riechstäbchen erkennen (z. B. Kaffee, Ananas oder Zimt). Geruchsstörungen sind häufig schon sehr früh im Krankheitsverlauf vorhanden und können mit anderen Beschwerden auf ein Parkinson-Syndrom hinweisen.
Zum Ausschluss möglicher Differenzialdiagnosen (z. B. eines Normaldruckhydrozephalus veranlasst der Arzt eine CT oder einen Kernspin des Gehirns. Der (indirekte) Nachweis eines Dopaminmangels im Gehirn ist mithilfe der PET oder SPECT möglich; diese sehr aufwendigen und teuren Untersuchungen werden jedoch nur in unklaren Fällen durchgeführt.
Bestätigt wird die Diagnose durch den Beginn einer L-Dopa-Therapie. Bessert sich daraufhin die Symptomatik im Verlauf, ist dies ein zusätzlicher Hinweis auf die Parkinson-Krankheit.
Differenzialdiagnosen. Bei Parkinson-typischen Beschwerden müssen zunächst alle möglichen sekundären Parkinson-Syndrome erkannt bzw. ausgeschlossen werden. Andere Erkrankungen, mit denen eine Parkinson-Krankheit verwechselt werden kann, sind Depression, der essenzielle Tremor und der Normaldruckhydrozephalus.
Behandlung
Da die idiopathische Parkinson-Krankheit mit Abstand am häufigsten ist, beziehen wir uns im Folgenden auf diese. Die Therapie des symptomatischen Parkinson-Syndroms hängt vom jeweiligen Auslöser ab, sie beinhaltet beispielsweise das Ersetzen von Medikamenten, die ein Parkinson-Syndrom auslösen können, mit "ungefährlichen" Wirkstoffen.
Pharmakotherapie
Wichtigster Bestandteil der Behandlung sind Medikamente zum Ausgleich des Dopaminmangels, die lebenslang eingenommen werden müssen. Es gibt zahlreiche Medikamente mit unterschiedlichen Wirkmechanismen, die der Arzt zur Wirkungsverstärkung häufig miteinander kombiniert:
- L-Dopa (Levodopa) ist die Vorstufe von Dopamin und soll das fehlende Dopamin im Gehirn ersetzen. Es lindert die Beschwerden am besten und ist das Medikament der ersten Wahl bei Patienten über 70 Jahren. Bei Jüngeren wird es möglichst vermieden, da es nach 5–10 Jahren häufig an Wirkung verliert und möglicherweise selbst zu Bewegungsstörungen führt. L-Dopa muss entweder ½–1 Stunde vor oder 1 ½ Stunden nach den Mahlzeiten eingenommen werden, da Eiweiß in der Nahrung seine Aufnahme ins Blut verhindert.
- Dopaminagonisten unterscheiden sich zwar chemisch vom Dopamin, greifen aber an den gleichen "Andockstationen" im Gehirn an und wirken somit ähnlich. Sie werden in "ergoline" (z. B. Bromocriptin, Cabergolin und Lisurid) und "nicht-ergoline" Dopaminagonisten. (z. B. Ropirinol oder Pramipexol) unterteilt. Da zusätzliche Bewegungsstörungen nach mehrjähriger Behandlung bei ihnen seltener beobachtet wurden als bei L-Dopa und sie möglicherweise den Nervenzelluntergang günstig beeinflussen, sind sie bei Patienten unter 70 Jahren Mittel der Wahl. Leider kommt es unter Einnahme von Dopaminagonisten bei einigen Patienten zu Impulskontrollstörungen. Diese äußern sich durch Ess-Attacken, Zwangshandlungen, gesteigerte Libido oder riskantes Verhalten bis hin zur Spiel- oder Kaufsucht. Daneben führen ergoline Dopaminagonisten häufig zu einer Verdickung der Herzklappen, weshalb nicht-ergolinen der Vorzug gegeben werden soll.
- COMT-Hemmer werden immer mit Levodopa und DOPA-Decarboxylase-Hemmern kombiniert. Sie sollen die Wirksamkeit von Levodopa verbessern, indem sie gemeinsam mit einem DOPA-Decarboxylase-Hemmer den Abbau von Levodopa reduzieren und so dessen Blutkonzentration erhöhen. Die Zusatzbehandlung mit COMT-Hemmern kommt für Patienten infrage, bei denen die Erkrankung weit fortgeschritten ist und die trotz Behandlung mit Levodopa und DOPA-Decarboxylase-Hemmern immer wiederkehrende Bewegungsstörungen haben. Der 2016 zugelassene COMT-Hemmer Opicapon ist im Gegensatz zu früheren Vertretern seiner Klasse nicht lebertoxisch und muss aufgrund seiner langen Wirkungsdauer nur einmal täglich verabreicht werden.
- MAO-B-Hemmer wie Selegilin und Rasagilin steigern ebenfalls die Dopaminverfügbarkeit im Gehirn, indem sie das Dopamin abbauende Enzym MAO-B hemmen. Ob sie darüber hinaus den Zelluntergang verlangsamen können, ist unklar. Sie wirken eher schwach und reichen daher als einziges Medikament nur bei leichtem Beschwerdebild, bei schwereren Formen kombiniert man sie mit L-Dopa. Typische Nebenwirkungen sind ein niedriger Blutdruck, insbesondere beim Aufstehen aus dem Sitzen, Schwindel oder Schlafstörungen.
- NMDA-Antagonisten wie Amantadin und Budipin sollen das gestörte Gleichgewicht zwischen den verschiedenen Botenstoffen im Gehirn verbessern. Auch sie werden vor allem im späteren Krankheitsverlauf in der Kombinationsbehandlung eingesetzt und wirken besonders gegen die typischen ungewollten Überbewegungen des Parkinson-Patienten. Wegen der Gefahr von Schlafstörungen ist es ratsam, Amantadin nach etwa 16 Uhr nicht mehr einzunehmen.
- Anticholinergika sollen ebenfalls das gestörte Botenstoffgleichgewicht wiederherstellen. Sie verbessern die Bewegungsarmut aber nur wenig. Deshalb und aufgrund ihres Nebenwirkungsprofils (z. B. Blasenstörungen, Gedächtnisstörungen und Mundtrockenheit) gelten sie als Mittel zweiter Wahl und werden bei alten Patienten nicht empfohlen.
Die Behandlung beginnt, sobald sich der Betroffene in seinen Aktivitäten eingeschränkt fühlt. Für einige Medikamente wird zwar diskutiert, ob sie den Nervenzelluntergang verzögern können und somit eine frühere Einnahme sinnvoll wäre, dies wird jedoch wegen der fehlenden Belege und der Nebenwirkungen der Medikamente derzeit nicht empfohlen. Die Medikamente dürfen nie abrupt abgesetzt werden, da dann eine rapide Verschlechterung der Beweglichkeit droht. Besonders häufige Nebenwirkungen sind Halluzinationen und andere psychotische Symptome. Regelmäßige Kontrolluntersuchungen sind unerlässlich.
Nicht selten kommt es nach Jahren zum Wirkungsverlust der Medikamente. Die Beweglichkeit wird kurz vor der nächsten Einnahme schlechter (End-of-Dose-Phänomen), wechselt stark innerhalb von Sekunden bis Minuten, als ob ein Schalter umgelegt würde (On-off-Phänomen), oder es kommt während der Spitzenkonzentration im Blut zu unkontrollierten "Überbewegungen". Häufig kann eine Medikamentenumstellung helfen, z. B. eine langsamer wirkende Retardtablette oder das Hinzufügen eines anderen Medikaments.
Tiefe Hirnstimulation und Stammzellen
Erzielen Medikamente keinen ausreichenden Erfolg oder können sie wegen zu starker Nebenwirkungen nicht "ausgereizt" werden, kommt für einen Teil der Patienten ein Hirnschrittmacher (genauer gesagt eine tiefe Hirnstimulation) in Betracht. Dabei werden dünne Elektroden in die gestörten Stellen im Gehirn eingepflanzt und mit einem Impulsgeber am Brustkorb verbunden (ähnlich wie beim Herzschrittmacher). Dieser sendet, von außen programmiert, elektrische Reize an die beeinträchtigten Zellen. Die Entscheidung, ob eine solche Behandlung sinnvoll ist, und die Behandlung selbst sind nur an spezialisierten Zentren möglich.
Stammzellentherapie. Alle Versuche, die untergegangenen Zellen im Gehirn zu ersetzen, sind bislang gescheitert. Hinzu kommen ethische Probleme, denn solche Zellen können bisher nicht im Labor gezüchtet werden, sondern stammen von Embryonen. Inzwischen laufen Versuche, die Parkinsonkrankheit durch das Einpflanzen von Stammzellen aus dem Blut oder der Haut erwachsener Individuen aufzuhalten, was im Tierversuch schon funktioniert hat.
Physiotherapie und Ergotherapie
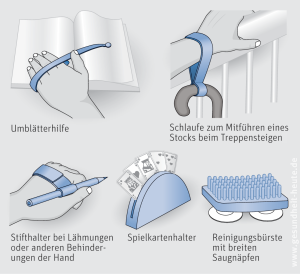
Unverzichtbarer Teil der Behandlung ist die Physiotherapie. Studien weisen darauf hin, dass ein früher Beginn der Physiotherapie die Dosierung der benötigten Medikamente reduziert. Darüber hinaus fördern sie die Beweglichkeit, beugen vor allem im fortgeschrittenen Stadium Folgeerkrankungen (z. B. Gelenkversteifungen) vor und tragen wesentlich dazu bei, die Selbstständigkeit des Betroffenen möglichst lange zu erhalten. Die Übungen müssen täglich durchgeführt werden, der Physiotherapeut stellt ein auf die Probleme und Fähigkeiten des Betroffenen abgestimmtes Heimübungsprogramm zusammen. Außerdem vermittelt der Physiotherapeut "Tricks" zur Überwindung spezieller Bewegungsprobleme. Beispielsweise kann der Betroffene mithilfe externer Stimuli und Zeitgeber lernen, plötzliche Bewegungsblockaden (Freezing) zu überwinden.
Bei der Bewältigung konkreter Alltagsprobleme hilft die Ergotherapie. Bei (deutlichen) Veränderungen der Sprache kann der Logopäde (Sprachtherapeut) helfen. Massagen sind bei schmerzhaften Muskelverspannungen angebracht. Auch ein regelmäßiges Ausdauertraining, z. B. durch Schwimmen, Wandern und/oder auf dem Ergometer, ist sinnvoll.
Ihr Apotheker empfiehlt
Was Sie selbst tun können
Nach der Diagnose "Parkinson-Krankheit" ist ein hohes Maß an Eigeninitiative, Mitarbeit und Verantwortungsbewusstsein seitens des Patienten notwendig, um das Voranschreiten der Krankheit möglichst lange hinauszuzögern. Eine Schlüsselrolle kommt der Regelmäßigkeit zu – dies gilt für die Einnahme der Medikamente wie für die täglichen Bewegungsübungen, die wesentlich für den Erhalt der Beweglichkeit sind. Welche für Sie besonders wichtig sind und wie Sie sie am besten durchführen, sagt Ihnen Ihr Physiotherapeut. Nur Übungen, bei denen neurophysiologisch richtig trainiert wird, haben den gewünschten Effekt.
- Achten Sie verstärkt auf die scheinbar unbedeutenden, alltäglichen Bewegungsabläufe. Vielleicht gelingt es Ihnen, durch bewusstes Steuern bestimmte Bewegungen zu verbessern, z. B. indem Sie versuchen, beim Gehen aktiv die Arme mitzubewegen, möglichst große Schritte zu machen oder schlurfende Schritte zu vermeiden.
- Auch Sprechprobleme können durch Training positiv beeinflusst werden. Spezielle Übungen lernen Sie bei einem Sprachtherapeuten.
- Durch tägliche Schreibübungen verhindern Sie, dass Ihre Schrift immer kleiner wird.
- Mithilfe von Atemübungen lernen Sie, tiefer ein- und auszuatmen.
- Scheuen Sie sich nicht, auf technische Hilfsmittel zurückzugreifen. Eine Gehhilfe aus dem Sanitätshaus bietet Ihnen im Zweifelsfall Sicherheit und Komfort. Ein Walkman oder ein Metronom kann Sie darin unterstützen, im Takt zu laufen und somit Bewegungsblockaden vorzubeugen.
- Wenn Ihnen ein Stimmungstief oder Stimmungsschwankungen zu schaffen machen, wenden Sie sich an Ihren Arzt. Eine Depression kann gut mit Medikamenten behandelt werden, vielleicht entschließen Sie sich auch zu einer Psychotherapie.
- Und auch dies gehört zum "Selbstmanagement": Gönnen Sie sich regelmäßig kleine Freuden und pflegen Sie Ihre sozialen Kontakte. Und vor allem: Wenn Sie Unterstützung brauchen, zögern Sie nicht, darum zu bitten und sie anzunehmen.
Hilfe durch Angehörige
Beim Selbstmanagement unterstützen. Am besten unterstützen Sie den Kranken, indem Sie sich zum Partner seines Selbstmanagements machen. Führen Sie mit ihm seine täglichen Bewegungs-, Sprech-, Schreib- und Gehübungen durch, setzen Sie sich dafür ein, dass die angemessenen Hilfsmittel erworben werden und ermutigen Sie ihn, seinen gewohnten Tätigkeiten nachzugehen.
Den Kranken mit einbeziehen. Auch bei der gemeinsamen Bewältigung des Alltags gilt: Nehmen Sie dem Betroffenen nur so viel ab wie unbedingt nötig. Übertragen Sie ihm Aufgaben und fragen Sie ihn nach seiner Meinung, wenn es um kleinere und größere Entscheidungen geht. Teilen Sie mit ihm Ihre Sorgen und Nöte. Auch wenn der Kranke vielleicht nicht mehr in der Lage ist, durch Mimik oder Gestik seine Gedanken und Gefühle zum Ausdruck zu bringen, so wird er Ihnen dennoch folgen und gute Ratschläge geben können.
Essen erleichtern. Spezielle Essbestecke erleichtern die Nahrungsaufnahme. Leidet der Betroffene an Schluckstörungen mit häufigem Verschlucken, kann breiige Kost ausprobiert werden.
Bewegungen führen. Versuchen Sie Bewegungsabläufe, zu denen der Patient momentan nicht in der Lage ist, selbst zu führen. Auf diese Weise bleibt er aktiv beteiligt und die eigenständige Bewegung kann sich wieder anbahnen. Dabei gilt es allerdings, sich in Geduld zu üben. Akzeptieren Sie, dass der Kranke nun ein anderes Tempo hat und setzen Sie ihn nicht unter Zeitdruck.
Wesensveränderungen beobachten. Eventuell auftretende Halluzinationen und Wahnvorstellungen sind Nebenwirkungen der Medikamente. Teilen Sie jedoch unbedingt dem behandelnden Arzt mit, wenn Sie solche Erscheinungen beobachten. Ein Frühzeichen für Halluzinationen können sehr lebhafte Träume sein. Nur in Spätstadien entwickeln einige Parkinson-Kranke die Symptome einer ›A: 13k01|Demenz
Komplementärmedizin
Alexander-Technik. Die ›A:33h46|Alexander-Technik hilft, Störungen im Bewegungsablauf von Parkinson-Patienten zu reduzieren. Der Betroffene lernt, Haltungsschwächen bis hin zu minimalen Verspannungen besser wahrzunehmen und bestimmte Bewegungen durch eine bewusste Korrektur zu verbessern. Hierfür sollten die Übungseinheiten regelmäßig durchgeführt werden. Gelernt wird die Alexander-Technik meist in Einzelstunden bei einem qualifizierten Trainer und kann dann ohne Anleitung zu Hause durchgeführt werden.
Ayurvedische Medizin. Die ›A:33h17|Ayurvedische Medizin stützt sich auf positive Erfahrungsberichte bei der Behandlung mit ayurvedischen Pflanzenmitteln, die entsprechend der ayurvedischen Lehre individuell ausgewählt werden. Da hoch konzentrierte Pflanzenextrakte ebenso wie synthetisch hergestellte Arzneimittel Nebenwirkungen haben können, sollten Nutzen und Risiko vor der Anwendung sorgfältig abgewogen werden.
Homöopathie. Die Homöopathie bietet z. B. Aranea diadema und Conium in niedrigen Potenzen (D4 bis D12) bei Zittern und Muskelzuckungen an, für spastische Muskelkontraktionen steht Kresol D6 oder D12 zur Verfügung, für eine starre Gliederhaltung, erhöhten Speichelfluss und ein maskenartiges Gesicht kommt Manganum D4 oder D6 infrage. Der Erfolg ist individuell zu beurteilen, die Wirksamkeit wurde bisher nicht nachgewiesen.
Weiterführende Informationen
- www.parkinson-vereinigung.de – Deutsche Parkinson-Vereinigung e. V. Bundesverband, Neuss: Internetseite der größten deutschen Parkinson-Fachgesellschaft, sehr informativ.
- www.kompetenznetz-parkinson.de – Vom Bundesministerium für Bildung und Forschung betriebene Internetseite: Mit ausführlichen und gut erklärten Informationen zu Symptomen und Diagnostik der Parkinson-Syndrome.
- M. J. Fox: Comeback. Lübbe, 2004. Der amerikanische Schauspieler Michael J. Fox berichtet über sein Leben vor und nach der Diagnose Parkinson.
